QUÍMICA TECNOLÓGICA
O futuro da construção civil aponta para o uso cada vez maior do gesso (CaSO4), seja em revestimentos, rebaixamentos ou divisórias. O gesso apresenta, porém, algumas desvantagens, que limitam seu uso. Em contato com água pode se dissolver, o que faz com que não possa ser utilizado em áreas externas, sujeitas a chuvas. Pode, entretanto, ser usado em áreas internas úmidas, como banheiros, por exemplo, desde que convenientemente protegido. Sabendo que a massa atômica do Ca = 40 u., do S = 32 u. e do O = 16 u., qual a fórmula percentual do gesso.
Ca51,4% S3,5% O45,1%
Ca25,0% S25,0% O50,0%
Ca29,4% S23,5% O47,1%
Ca11,6% S23,5% O64,9%
Ca9,3% S33,5% O57,2%
Em uma das etapas do tratamento de água ocorre a adsorção de partículas em uma massa gelatinosa constituída de hidróxido de alumínio. Esta substância é preparada pela adição de Ca(OH)2 e Al2(SO4)3 à água contida em tanques de tratamento. Qual das alternativa contém os coeficientes estequiométricos corretos, dessa reação química.
Ca(OH)2 + Al2(SO4)3 ----> Al(OH)3 + CaSO4
3 ; 1 ; 2 ; 3
2 ; 1 ; 2 ; 1
1 ; 1 ; 1 ; 1
1 ; 1 ; 1 ; 3
3 ; 2 ; 2 ; 3
Um estudante de química balanceou as equações abaixo:
I. 2 NH3 + HCl ----> 3 NH4Cl
II. BaCl2 + H2SO4 ----> 2 HCl + BaSO4
III. C2H6O + 3 O2 ----> 2 CO2 + 3 H2O
IV. 2 N2 + 3 H2 ----> 2 NH3
Qual(is) equação(ões) esta(ão) balanceada(s) corretamente:
II e IV apenas.
II e III apenas.
I e IV apenas.
I e III apenas.
I e II apenas.
Como sabemos a corrosão pode ocorrer de várias formas e provocada pelos mais diversos fatores. Com relação à corrosão eletroquímica, está claro que uma reação de oxi-redução pode provocar a corrosão dos mais diversos materiais. Com isso em mente, identifique a alternativa que contém uma reação química que demonstra um processo de corrosão (oxidação).
Cu(s) + O2(g) = CuO2(s)
CaCO3(s) = CaO(s) + CO2(g)
ZnO(s) + 2 HCl(l) = ZnCl2(s) + H2O(l)
NaOH(aq) + HCl(aq) = NaCl(aq) + H2O(l)
H2O(l) + SO2(g) = H2SO3(g)
Por efeito de descargas elétricas, o ozônio pode ser formado, na atmosfera, a partir da sequência de reações representadas a seguir:
I — N2 + O2 → 2 NO
II — 2 NO + O2 → 2 NO2
III — NO2 + O2 → NO + O3
Considerando as reações no sentido direto, pode se afirmar que ocorre oxidação do nitrogênio:
apenas em I
em I, II e III
apenas em I e III
apenas em I e II
apenas em II
Analisando as estruturas abaixo, qual é aquela que apresenta, corretamente, a estrutura de Lewis para um composto estável eletronicamente, formado por ligação covalente.
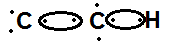
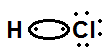

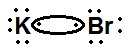

O gás carbônico (CO2) é um dos principais gases de efeito estufa, enquanto o monóxido de enxofre (SO) é um dos responsáveis pela poluição atmosférica que gera a chuva ácida. Se considerarmos uma molécula do CO2 e uma molécula do SO, podemos afirmar que o tipo de ligação que ocorre, respectivamente, em cada molécula é:
Dados: C (Z = 6); O (Z = 8); S (Z = 16)
Ligação iônica e ligação iônica.
Ligação covalente e ligação iônica.
Ligação covalente e ligação metálica.
Ligação metálica e ligação iônica.
Ligação covalente e ligação covalente.
A análise de urina é um dos exames que devem ser feitos periodicamente para avaliação da saúde animal. Em um exame observou-se que a amostra de urina apresentava pH = 5. Daí podemos concluir que:
a urina é uma solução não-eletrolítica.
a solução tem caráter básico.
a concentração hidroxiliônica é de 10–7 mol/L.
o grau de ionização da água é 10–5.
a concentração hidrogeniônica é 10–5 mol/L.
No equilíbrio 2 HI (g) = H2 (g) I2 (g), encontramos as seguintes concentrações: 10 mol/L de H2 e 0,01 mol/L de I2. Qual é a concentração em mol/L do HI, sabendo que, nas condições de experiência, Kc vale 10-3?
7,0 mol/L
10,0 mol/L
20 mol/L
12,0 mol/L
1,0 mol/L
Em grandes construções, as estruturas metálicas são soldadas utilizando maçarico de acetileno (C2H2). Qual é a número de mols de gás oxigênio necessário para fornecer 17,5 mol de água, H2O(v), na queima completa do acetileno, C2H2(g), baseando-se na equação química não balanceada abaixo? (dados: C = 12 g/mol; H = 1 g/mol; O = 16 g/mol)
C2H2(g) + O2 ----> CO2(g) + H2O(v)
Ca51,4% S3,5% O45,1%
Ca25,0% S25,0% O50,0%
Ca29,4% S23,5% O47,1%
Ca11,6% S23,5% O64,9%
Ca9,3% S33,5% O57,2%
Em uma das etapas do tratamento de água ocorre a adsorção de partículas em uma massa gelatinosa constituída de hidróxido de alumínio. Esta substância é preparada pela adição de Ca(OH)2 e Al2(SO4)3 à água contida em tanques de tratamento. Qual das alternativa contém os coeficientes estequiométricos corretos, dessa reação química.
Ca(OH)2 + Al2(SO4)3 ----> Al(OH)3 + CaSO4
3 ; 1 ; 2 ; 3
2 ; 1 ; 2 ; 1
1 ; 1 ; 1 ; 1
1 ; 1 ; 1 ; 3
3 ; 2 ; 2 ; 3
Um estudante de química balanceou as equações abaixo:
I. 2 NH3 + HCl ----> 3 NH4Cl
II. BaCl2 + H2SO4 ----> 2 HCl + BaSO4
III. C2H6O + 3 O2 ----> 2 CO2 + 3 H2O
IV. 2 N2 + 3 H2 ----> 2 NH3
Qual(is) equação(ões) esta(ão) balanceada(s) corretamente:
II e IV apenas.
II e III apenas.
I e IV apenas.
I e III apenas.
I e II apenas.
Como sabemos a corrosão pode ocorrer de várias formas e provocada pelos mais diversos fatores. Com relação à corrosão eletroquímica, está claro que uma reação de oxi-redução pode provocar a corrosão dos mais diversos materiais. Com isso em mente, identifique a alternativa que contém uma reação química que demonstra um processo de corrosão (oxidação).
Cu(s) + O2(g) = CuO2(s)
CaCO3(s) = CaO(s) + CO2(g)
ZnO(s) + 2 HCl(l) = ZnCl2(s) + H2O(l)
NaOH(aq) + HCl(aq) = NaCl(aq) + H2O(l)
H2O(l) + SO2(g) = H2SO3(g)
Por efeito de descargas elétricas, o ozônio pode ser formado, na atmosfera, a partir da sequência de reações representadas a seguir:
I — N2 + O2 → 2 NO
II — 2 NO + O2 → 2 NO2
III — NO2 + O2 → NO + O3
Considerando as reações no sentido direto, pode se afirmar que ocorre oxidação do nitrogênio:
apenas em I
em I, II e III
apenas em I e III
apenas em I e II
apenas em II
Analisando as estruturas abaixo, qual é aquela que apresenta, corretamente, a estrutura de Lewis para um composto estável eletronicamente, formado por ligação covalente.
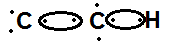
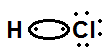

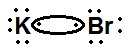

O gás carbônico (CO2) é um dos principais gases de efeito estufa, enquanto o monóxido de enxofre (SO) é um dos responsáveis pela poluição atmosférica que gera a chuva ácida. Se considerarmos uma molécula do CO2 e uma molécula do SO, podemos afirmar que o tipo de ligação que ocorre, respectivamente, em cada molécula é:
Dados: C (Z = 6); O (Z = 8); S (Z = 16)
Ligação iônica e ligação iônica.
Ligação covalente e ligação iônica.
Ligação covalente e ligação metálica.
Ligação metálica e ligação iônica.
Ligação covalente e ligação covalente.
A análise de urina é um dos exames que devem ser feitos periodicamente para avaliação da saúde animal. Em um exame observou-se que a amostra de urina apresentava pH = 5. Daí podemos concluir que:
a urina é uma solução não-eletrolítica.
a solução tem caráter básico.
a concentração hidroxiliônica é de 10–7 mol/L.
o grau de ionização da água é 10–5.
a concentração hidrogeniônica é 10–5 mol/L.
No equilíbrio 2 HI (g) = H2 (g) I2 (g), encontramos as seguintes concentrações: 10 mol/L de H2 e 0,01 mol/L de I2. Qual é a concentração em mol/L do HI, sabendo que, nas condições de experiência, Kc vale 10-3?
7,0 mol/L
10,0 mol/L
20 mol/L
12,0 mol/L
1,0 mol/L
Em grandes construções, as estruturas metálicas são soldadas utilizando maçarico de acetileno (C2H2). Qual é a número de mols de gás oxigênio necessário para fornecer 17,5 mol de água, H2O(v), na queima completa do acetileno, C2H2(g), baseando-se na equação química não balanceada abaixo? (dados: C = 12 g/mol; H = 1 g/mol; O = 16 g/mol)
C2H2(g) + O2 ----> CO2(g) + H2O(v)
3 ; 1 ; 2 ; 3
2 ; 1 ; 2 ; 1
1 ; 1 ; 1 ; 1
1 ; 1 ; 1 ; 3
3 ; 2 ; 2 ; 3
Um estudante de química balanceou as equações abaixo:
I. 2 NH3 + HCl ----> 3 NH4Cl
II. BaCl2 + H2SO4 ----> 2 HCl + BaSO4
III. C2H6O + 3 O2 ----> 2 CO2 + 3 H2O
IV. 2 N2 + 3 H2 ----> 2 NH3
Qual(is) equação(ões) esta(ão) balanceada(s) corretamente:
II e IV apenas.
II e III apenas.
I e IV apenas.
I e III apenas.
I e II apenas.
Como sabemos a corrosão pode ocorrer de várias formas e provocada pelos mais diversos fatores. Com relação à corrosão eletroquímica, está claro que uma reação de oxi-redução pode provocar a corrosão dos mais diversos materiais. Com isso em mente, identifique a alternativa que contém uma reação química que demonstra um processo de corrosão (oxidação).
Cu(s) + O2(g) = CuO2(s)
CaCO3(s) = CaO(s) + CO2(g)
ZnO(s) + 2 HCl(l) = ZnCl2(s) + H2O(l)
NaOH(aq) + HCl(aq) = NaCl(aq) + H2O(l)
H2O(l) + SO2(g) = H2SO3(g)
Por efeito de descargas elétricas, o ozônio pode ser formado, na atmosfera, a partir da sequência de reações representadas a seguir:
I — N2 + O2 → 2 NO
II — 2 NO + O2 → 2 NO2
III — NO2 + O2 → NO + O3
Considerando as reações no sentido direto, pode se afirmar que ocorre oxidação do nitrogênio:
apenas em I
em I, II e III
apenas em I e III
apenas em I e II
apenas em II
Analisando as estruturas abaixo, qual é aquela que apresenta, corretamente, a estrutura de Lewis para um composto estável eletronicamente, formado por ligação covalente.
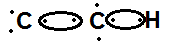
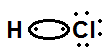

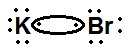

O gás carbônico (CO2) é um dos principais gases de efeito estufa, enquanto o monóxido de enxofre (SO) é um dos responsáveis pela poluição atmosférica que gera a chuva ácida. Se considerarmos uma molécula do CO2 e uma molécula do SO, podemos afirmar que o tipo de ligação que ocorre, respectivamente, em cada molécula é:
Dados: C (Z = 6); O (Z = 8); S (Z = 16)
Ligação iônica e ligação iônica.
Ligação covalente e ligação iônica.
Ligação covalente e ligação metálica.
Ligação metálica e ligação iônica.
Ligação covalente e ligação covalente.
A análise de urina é um dos exames que devem ser feitos periodicamente para avaliação da saúde animal. Em um exame observou-se que a amostra de urina apresentava pH = 5. Daí podemos concluir que:
a urina é uma solução não-eletrolítica.
a solução tem caráter básico.
a concentração hidroxiliônica é de 10–7 mol/L.
o grau de ionização da água é 10–5.
a concentração hidrogeniônica é 10–5 mol/L.
No equilíbrio 2 HI (g) = H2 (g) I2 (g), encontramos as seguintes concentrações: 10 mol/L de H2 e 0,01 mol/L de I2. Qual é a concentração em mol/L do HI, sabendo que, nas condições de experiência, Kc vale 10-3?
7,0 mol/L
10,0 mol/L
20 mol/L
12,0 mol/L
1,0 mol/L
Em grandes construções, as estruturas metálicas são soldadas utilizando maçarico de acetileno (C2H2). Qual é a número de mols de gás oxigênio necessário para fornecer 17,5 mol de água, H2O(v), na queima completa do acetileno, C2H2(g), baseando-se na equação química não balanceada abaixo? (dados: C = 12 g/mol; H = 1 g/mol; O = 16 g/mol)
C2H2(g) + O2 ----> CO2(g) + H2O(v)
II. BaCl2 + H2SO4 ----> 2 HCl + BaSO4
III. C2H6O + 3 O2 ----> 2 CO2 + 3 H2O
IV. 2 N2 + 3 H2 ----> 2 NH3
II e IV apenas.
II e III apenas.
I e IV apenas.
I e III apenas.
I e II apenas.
Como sabemos a corrosão pode ocorrer de várias formas e provocada pelos mais diversos fatores. Com relação à corrosão eletroquímica, está claro que uma reação de oxi-redução pode provocar a corrosão dos mais diversos materiais. Com isso em mente, identifique a alternativa que contém uma reação química que demonstra um processo de corrosão (oxidação).
Cu(s) + O2(g) = CuO2(s)
CaCO3(s) = CaO(s) + CO2(g)
ZnO(s) + 2 HCl(l) = ZnCl2(s) + H2O(l)
NaOH(aq) + HCl(aq) = NaCl(aq) + H2O(l)
H2O(l) + SO2(g) = H2SO3(g)
Por efeito de descargas elétricas, o ozônio pode ser formado, na atmosfera, a partir da sequência de reações representadas a seguir:
I — N2 + O2 → 2 NO
II — 2 NO + O2 → 2 NO2
III — NO2 + O2 → NO + O3
Considerando as reações no sentido direto, pode se afirmar que ocorre oxidação do nitrogênio:
apenas em I
em I, II e III
apenas em I e III
apenas em I e II
apenas em II
Analisando as estruturas abaixo, qual é aquela que apresenta, corretamente, a estrutura de Lewis para um composto estável eletronicamente, formado por ligação covalente.
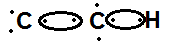
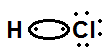

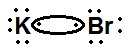

O gás carbônico (CO2) é um dos principais gases de efeito estufa, enquanto o monóxido de enxofre (SO) é um dos responsáveis pela poluição atmosférica que gera a chuva ácida. Se considerarmos uma molécula do CO2 e uma molécula do SO, podemos afirmar que o tipo de ligação que ocorre, respectivamente, em cada molécula é:
Dados: C (Z = 6); O (Z = 8); S (Z = 16)
Ligação iônica e ligação iônica.
Ligação covalente e ligação iônica.
Ligação covalente e ligação metálica.
Ligação metálica e ligação iônica.
Ligação covalente e ligação covalente.
A análise de urina é um dos exames que devem ser feitos periodicamente para avaliação da saúde animal. Em um exame observou-se que a amostra de urina apresentava pH = 5. Daí podemos concluir que:
a urina é uma solução não-eletrolítica.
a solução tem caráter básico.
a concentração hidroxiliônica é de 10–7 mol/L.
o grau de ionização da água é 10–5.
a concentração hidrogeniônica é 10–5 mol/L.
No equilíbrio 2 HI (g) = H2 (g) I2 (g), encontramos as seguintes concentrações: 10 mol/L de H2 e 0,01 mol/L de I2. Qual é a concentração em mol/L do HI, sabendo que, nas condições de experiência, Kc vale 10-3?
7,0 mol/L
10,0 mol/L
20 mol/L
12,0 mol/L
1,0 mol/L
Em grandes construções, as estruturas metálicas são soldadas utilizando maçarico de acetileno (C2H2). Qual é a número de mols de gás oxigênio necessário para fornecer 17,5 mol de água, H2O(v), na queima completa do acetileno, C2H2(g), baseando-se na equação química não balanceada abaixo? (dados: C = 12 g/mol; H = 1 g/mol; O = 16 g/mol)
C2H2(g) + O2 ----> CO2(g) + H2O(v)
Cu(s) + O2(g) = CuO2(s)
CaCO3(s) = CaO(s) + CO2(g)
ZnO(s) + 2 HCl(l) = ZnCl2(s) + H2O(l)
NaOH(aq) + HCl(aq) = NaCl(aq) + H2O(l)
H2O(l) + SO2(g) = H2SO3(g)
Por efeito de descargas elétricas, o ozônio pode ser formado, na atmosfera, a partir da sequência de reações representadas a seguir:
I — N2 + O2 → 2 NO
II — 2 NO + O2 → 2 NO2
III — NO2 + O2 → NO + O3
Considerando as reações no sentido direto, pode se afirmar que ocorre oxidação do nitrogênio:
apenas em I
em I, II e III
apenas em I e III
apenas em I e II
apenas em II
Analisando as estruturas abaixo, qual é aquela que apresenta, corretamente, a estrutura de Lewis para um composto estável eletronicamente, formado por ligação covalente.
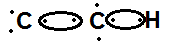
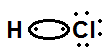

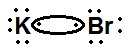

O gás carbônico (CO2) é um dos principais gases de efeito estufa, enquanto o monóxido de enxofre (SO) é um dos responsáveis pela poluição atmosférica que gera a chuva ácida. Se considerarmos uma molécula do CO2 e uma molécula do SO, podemos afirmar que o tipo de ligação que ocorre, respectivamente, em cada molécula é:
Dados: C (Z = 6); O (Z = 8); S (Z = 16)
Ligação iônica e ligação iônica.
Ligação covalente e ligação iônica.
Ligação covalente e ligação metálica.
Ligação metálica e ligação iônica.
Ligação covalente e ligação covalente.
A análise de urina é um dos exames que devem ser feitos periodicamente para avaliação da saúde animal. Em um exame observou-se que a amostra de urina apresentava pH = 5. Daí podemos concluir que:
a urina é uma solução não-eletrolítica.
a solução tem caráter básico.
a concentração hidroxiliônica é de 10–7 mol/L.
o grau de ionização da água é 10–5.
a concentração hidrogeniônica é 10–5 mol/L.
No equilíbrio 2 HI (g) = H2 (g) I2 (g), encontramos as seguintes concentrações: 10 mol/L de H2 e 0,01 mol/L de I2. Qual é a concentração em mol/L do HI, sabendo que, nas condições de experiência, Kc vale 10-3?
7,0 mol/L
10,0 mol/L
20 mol/L
12,0 mol/L
1,0 mol/L
Em grandes construções, as estruturas metálicas são soldadas utilizando maçarico de acetileno (C2H2). Qual é a número de mols de gás oxigênio necessário para fornecer 17,5 mol de água, H2O(v), na queima completa do acetileno, C2H2(g), baseando-se na equação química não balanceada abaixo? (dados: C = 12 g/mol; H = 1 g/mol; O = 16 g/mol)
C2H2(g) + O2 ----> CO2(g) + H2O(v)
apenas em I
em I, II e III
apenas em I e III
apenas em I e II
apenas em II
Analisando as estruturas abaixo, qual é aquela que apresenta, corretamente, a estrutura de Lewis para um composto estável eletronicamente, formado por ligação covalente.
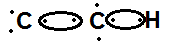
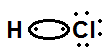

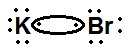

O gás carbônico (CO2) é um dos principais gases de efeito estufa, enquanto o monóxido de enxofre (SO) é um dos responsáveis pela poluição atmosférica que gera a chuva ácida. Se considerarmos uma molécula do CO2 e uma molécula do SO, podemos afirmar que o tipo de ligação que ocorre, respectivamente, em cada molécula é:
Dados: C (Z = 6); O (Z = 8); S (Z = 16)
Ligação iônica e ligação iônica.
Ligação covalente e ligação iônica.
Ligação covalente e ligação metálica.
Ligação metálica e ligação iônica.
Ligação covalente e ligação covalente.
A análise de urina é um dos exames que devem ser feitos periodicamente para avaliação da saúde animal. Em um exame observou-se que a amostra de urina apresentava pH = 5. Daí podemos concluir que:
a urina é uma solução não-eletrolítica.
a solução tem caráter básico.
a concentração hidroxiliônica é de 10–7 mol/L.
o grau de ionização da água é 10–5.
a concentração hidrogeniônica é 10–5 mol/L.
No equilíbrio 2 HI (g) = H2 (g) I2 (g), encontramos as seguintes concentrações: 10 mol/L de H2 e 0,01 mol/L de I2. Qual é a concentração em mol/L do HI, sabendo que, nas condições de experiência, Kc vale 10-3?
7,0 mol/L
10,0 mol/L
20 mol/L
12,0 mol/L
1,0 mol/L
Em grandes construções, as estruturas metálicas são soldadas utilizando maçarico de acetileno (C2H2). Qual é a número de mols de gás oxigênio necessário para fornecer 17,5 mol de água, H2O(v), na queima completa do acetileno, C2H2(g), baseando-se na equação química não balanceada abaixo? (dados: C = 12 g/mol; H = 1 g/mol; O = 16 g/mol)
C2H2(g) + O2 ----> CO2(g) + H2O(v)
![]()
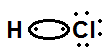
![]()
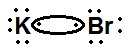
![]()
O gás carbônico (CO2) é um dos principais gases de efeito estufa, enquanto o monóxido de enxofre (SO) é um dos responsáveis pela poluição atmosférica que gera a chuva ácida. Se considerarmos uma molécula do CO2 e uma molécula do SO, podemos afirmar que o tipo de ligação que ocorre, respectivamente, em cada molécula é:
Dados: C (Z = 6); O (Z = 8); S (Z = 16)
Ligação iônica e ligação iônica.
Ligação covalente e ligação iônica.
Ligação covalente e ligação metálica.
Ligação metálica e ligação iônica.
Ligação covalente e ligação covalente.
A análise de urina é um dos exames que devem ser feitos periodicamente para avaliação da saúde animal. Em um exame observou-se que a amostra de urina apresentava pH = 5. Daí podemos concluir que:
a urina é uma solução não-eletrolítica.
a solução tem caráter básico.
a concentração hidroxiliônica é de 10–7 mol/L.
o grau de ionização da água é 10–5.
a concentração hidrogeniônica é 10–5 mol/L.
No equilíbrio 2 HI (g) = H2 (g) I2 (g), encontramos as seguintes concentrações: 10 mol/L de H2 e 0,01 mol/L de I2. Qual é a concentração em mol/L do HI, sabendo que, nas condições de experiência, Kc vale 10-3?
7,0 mol/L
10,0 mol/L
20 mol/L
12,0 mol/L
1,0 mol/L
Em grandes construções, as estruturas metálicas são soldadas utilizando maçarico de acetileno (C2H2). Qual é a número de mols de gás oxigênio necessário para fornecer 17,5 mol de água, H2O(v), na queima completa do acetileno, C2H2(g), baseando-se na equação química não balanceada abaixo? (dados: C = 12 g/mol; H = 1 g/mol; O = 16 g/mol)
C2H2(g) + O2 ----> CO2(g) + H2O(v)
Ligação iônica e ligação iônica.
Ligação covalente e ligação iônica.
Ligação covalente e ligação metálica.
Ligação metálica e ligação iônica.
Ligação covalente e ligação covalente.
A análise de urina é um dos exames que devem ser feitos periodicamente para avaliação da saúde animal. Em um exame observou-se que a amostra de urina apresentava pH = 5. Daí podemos concluir que:
a urina é uma solução não-eletrolítica.
a solução tem caráter básico.
a concentração hidroxiliônica é de 10–7 mol/L.
o grau de ionização da água é 10–5.
a concentração hidrogeniônica é 10–5 mol/L.
No equilíbrio 2 HI (g) = H2 (g) I2 (g), encontramos as seguintes concentrações: 10 mol/L de H2 e 0,01 mol/L de I2. Qual é a concentração em mol/L do HI, sabendo que, nas condições de experiência, Kc vale 10-3?
7,0 mol/L
10,0 mol/L
20 mol/L
12,0 mol/L
1,0 mol/L
Em grandes construções, as estruturas metálicas são soldadas utilizando maçarico de acetileno (C2H2). Qual é a número de mols de gás oxigênio necessário para fornecer 17,5 mol de água, H2O(v), na queima completa do acetileno, C2H2(g), baseando-se na equação química não balanceada abaixo? (dados: C = 12 g/mol; H = 1 g/mol; O = 16 g/mol)
C2H2(g) + O2 ----> CO2(g) + H2O(v)
a urina é uma solução não-eletrolítica.
a solução tem caráter básico.
a concentração hidroxiliônica é de 10–7 mol/L.
o grau de ionização da água é 10–5.
a concentração hidrogeniônica é 10–5 mol/L.
No equilíbrio 2 HI (g) = H2 (g) I2 (g), encontramos as seguintes concentrações: 10 mol/L de H2 e 0,01 mol/L de I2. Qual é a concentração em mol/L do HI, sabendo que, nas condições de experiência, Kc vale 10-3?
7,0 mol/L
10,0 mol/L
20 mol/L
12,0 mol/L
1,0 mol/L
Em grandes construções, as estruturas metálicas são soldadas utilizando maçarico de acetileno (C2H2). Qual é a número de mols de gás oxigênio necessário para fornecer 17,5 mol de água, H2O(v), na queima completa do acetileno, C2H2(g), baseando-se na equação química não balanceada abaixo? (dados: C = 12 g/mol; H = 1 g/mol; O = 16 g/mol)
C2H2(g) + O2 ----> CO2(g) + H2O(v)
7,0 mol/L
10,0 mol/L
20 mol/L
12,0 mol/L
1,0 mol/L